打开文本图片集
[摘要] 目的 研究宮颈癌组织中信号转导和转录激活因子3(STAT3)、高迁移率族蛋白B1(HMGB1)的表达及其临床意义。 方法 收集2015年1月~2018年12月于辽宁省肿瘤医院进行宫颈癌根治术患者65例的临床资料,同时选取因子宫肌瘤进行全子宫切除术患者26例作为对照。采用免疫组织化学法检测65例宫颈癌组织及26例正常宫颈组织中的STAT3、HMGB1的表达,分析癌组织中STAT3和HMGB1的相关性及两者与宫颈癌患者临床病理特征的关系。 结果 宫颈癌组织中STAT3和HMGB1的阳性表达率均高于正常宫颈组织(P < 0.05)。STAT3的表达与盆腔淋巴结转移情况、国际妇产科联盟(FIGO)分期、肌层浸润深度有关(P < 0.05),而HMGB1的表达与患者年龄、盆腔淋巴结转移情况及肌层浸润深度有关(P < 0.05)。宫颈癌组织中STAT3与HMGB1的表达呈正相关(rs = 0.371,P < 0.05)。 结论 STAT3、HMGB1在宫颈癌组织中高表达且具有一定的相关性,同时与肿瘤分期、浸润程度等临床病理特征相关。
[关键词] 宫颈癌、信号转导和转录激活因子3、高迁移率族蛋白B1、肿瘤分期
[中图分类号] R737.33 [文献标识码] A [文章编号] 1673-7210(2019)10(b)-0104-04
Expression and clinical significance of STAT3 and HMGB1 in cervical cancer tissue
ZHENG Wei ZHANG Hanxue CAO Rong
Department of Gynaecology, Liaoning Cancer Hospital and Institute, Liaoning Province, Shenyang 110042, China
[Abstract] Objective To study the expression of signal transduction and activator of transcription 3 (STAT3) and high mobility group protein B1 (HMGB1) in cervical cancer tissues and their clinical significance. Methods Clinical data of 65 patients undergoing radical cervical cancer surgery in Liaoning Cancer Hospital and Institute from January 2015 to December 2018 were collected. Meanwhile, 26 patients undergoing total hysterectomy due to uterine fibroids were selected as a comparison. Immunohistochemistry was used to detect the expression of STAT3 and HMGB1 in 65 cervical cancer tissues and 26 normal cervical tissues. The correlation between STAT3 and HMGB1 in cancer tissues and their relationship with the clinical pathological characteristics of cervical cancer patients were analyzed. Results The positive expression rates of STAT3 and HMGB1 in cervical cancer tissues were higher than those in normal cervical tissues (P < 0.05). The expression of STAT3 was related to pelvic lymph node metastasis condition, international federation of gynecology and obstetrics (FIGO) stage and depth of myometrial tumor invasion (P < 0.05), while the expression of HMGB1 was related to age of patients, pelvic lymph node metastasis and depth of myometrial tumor invasion (P < 0.05). There was a positive correlation between the expression of STAT3 and HMGB1 in cervical cancer tissues (rs = 0.371, P < 0.05). Conclusion STAT3 and HMGB1 are highly expressed in cervical cancer tissues and have certain correlation, and are also correlated with the clinical pathological characteristics such as tumor stage and invasion degree.
[Key words] Cervical cancer; Signal transduction and activator of transcription 3; High mobility group protein B1; Tumor stage
宫颈癌是由人乳头瘤病毒(HPV)所引起的女性生殖系统恶性肿瘤,每年有52万新增病例,死亡病例达27万[1]。虽然近年来宫颈癌的早期筛查已逐渐普及,宫颈癌的发病率有所下降,但仍存在年轻化的趋势。手术及放化疗等治疗手段降低了患者病死率,延长了患者生存时间,但部分患者术后出现复发及远处转移,严重影响患者的生存预后,如何提高患者术后远期生存率现成为研究的重点。信号转导和转录激活因子3(STAT3)编码的蛋白质是STAT蛋白质家族的成员。在细胞外生长因子刺激下,STAT3被生长因子受体的激酶磷酸化,形成同二聚体或异二聚体,并易位至细胞核,作为转录激活因子,可介导多种基因的表达,参与细胞生长、凋亡等多种细胞过程。研究[2]表明,肿瘤中STAT3表达上调,可促进多种信号通路基因的表达,这与肿瘤细胞的增殖、侵袭转移及免疫逃逸等有关。高迁移率族蛋白B1(HMGB1)属于高迁移率族超家族的蛋白质,编码的非组蛋白核DNA结合蛋白能够调节转录,同时,其与多种肿瘤的发生发展、侵袭浸润及预后均有一定的相关性[3]。本研究通过分析宫颈癌患者的临床及病理资料,采用免疫组化分别检测STAT3、HMGB1在宫颈癌组织中的表达及与宫颈癌患者临床病理特征的关系,为宫颈癌术后评估复发率提供参考。
1 對象与方法
1.1 研究对象
收集2015年1月~2018年12月于辽宁省肿瘤医院(以下简称“我院”)进行宫颈癌根治术、术后病理证实的原发性宫颈癌患者的宫颈癌组织标本共65例。年龄40~71岁,平均(52.16±6.01)岁。同时以我院同期因子宫肌瘤行全子宫切除术的26例子宫肌瘤患者作为对照,所有患者经术后病理检查明确无肿瘤存在。年龄45~59岁,平均(50.23±5.68)岁。纳入标准:①患者以往无放化疗、分子靶向治疗等治疗史;②以国际妇产科联盟(FIGO)于2009年制订的FIGO标准进行肿瘤分期[4]。排除标准:①同时合并妊娠;②合并消化系统、呼吸系统肿瘤等其他脏器恶性肿瘤;③术前曾阴道用药等宫颈治疗;④合并生殖系统其他恶性肿瘤。两组患者在性别、年龄等一般资料比较,差异无统计学意义(P > 0.05),具有可比性。本实验经我院医学伦理委员会批准后开始收集。
1.2免疫组化检测STAT3、HMGB1表达
收集宫颈癌组织及正常宫颈组织标本,10%甲醛固定,石蜡包埋,4 μm厚度连续切片,常规链霉菌抗生素蛋白-过氧化物酶连接法(SP法)染色。实验步骤:常规二甲苯脱蜡、梯度乙醇水化,通过柠檬酸盐缓冲液微波炉法进行热抗原修复,灭活内源性过氧化物的活性,封闭非特异性位点。一抗为鼠抗人STAT3单抗(赛信通上海生物试剂有限公司,批号:20141227)及兔抗人HMGB1单克隆抗体(武汉明德生物有限公司,批号:20141103),一抗STAT3、HMGB1的稀释浓度均为1∶400。4℃条件下孵箱一抗孵育过夜,进行复温,加入二抗反应后,应用DAB染液显色,苏木精复染,逐级梯度脱水,中性树脂封片。
1.3结果判定
将切片放置于高倍镜(400×)下,随机选取5个视野,并计数1000个细胞,每个视野蛋白表达情况以染色深度评分和阳性细胞百分比评分之和表示,计算5个视野的平均值,均值为0~2为阴性,>2为阳性表达[5]。染色深度评分:无染色为0分,浅黄色1分,棕黄色2分,棕褐色3分。阳性细胞百分比评分:无染色为0分,阳性细胞数≤25%为1分,25%<阳性细胞数≤50%为2分,>50%为3分。
1.4统计学方法
采用SPSS 18.0统计学软件对所得数据进行统计学分析,计数资料采用百分率表示,组间比较采用χ2检验。STAT3、HMGB1的相关性采用Spearman等级相关分析,以P < 0.05为差异有统计学意义。
2 结果
2.1 STAT3、HMGB1在宫颈癌组织中的表达
宫颈癌组织中均可明显见到棕黄色细胞,且宫颈癌组织中STAT3和HMGB1的阳性率明显高于正常宫颈组织(P < 0.05)。见图1(封三)、表1。
2.2 STAT3、HMGB1与临床特征的关系
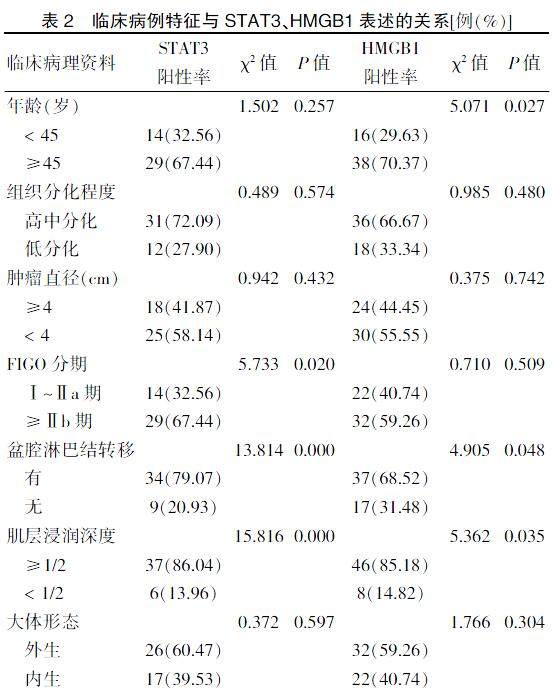
STAT3的表达与盆腔淋巴结转移情况、FIGO分期、肌层浸润深度有关(P < 0.05),而与患者年龄、组织分化程度、肿瘤直径、大体形态无明显相关性(P > 0.05)。HMGB1的表达与患者年龄、盆腔淋巴结转移情况及肌层浸润深度有关(P < 0.05),而与组织分化程度、肿瘤直径、FIGO分期、大体形态无明显相关性,差异无统计学意义(P > 0.05)。见表2。
2.3 STAT3与HMGB1的关系
由Spearman等级相关分析,STAT3的表达与HMGB1的表达呈正相关(rs = 0.371,P = 0.020)。
3 讨论
宫颈癌是女性最常见的生殖系统恶性肿瘤之一[6-7],在所有女性生殖系统肿瘤的发病率中排第一。随着宫颈癌宫颈涂片细胞学及HPV基因筛查技术的发展,其发病率有逐渐降低的趋势,随着腹腔镜手术方法的改良及放、化疗方式的提高,病死率也有所降低,但宫颈癌术后复发率及远处转移依然是影响患者远期生存率的重要因素。宫颈癌的发病现出现了年轻化的趋势,严重危害妇女健康。肿瘤的发生发展是一个多因素、多阶段的过程,肿瘤微环境中T细胞、巨噬细胞等细胞的功能异常,导致肿瘤细胞的Wnt等信号通路的过度活化,促进肿瘤细胞的恶性转化并使其获得无限增殖潜能[8]。对影响宫颈癌发展的信号通路的关键转录因子及下游关键癌基因的表达的研究,是近年来肿瘤研究的热点。
STAT3是属于STAT家族的一种重要的转录因子,其编码基因位于人第17号染色体,蛋白由750~800个氨基酸组成。位于细胞质中的STAT3在外界多种信号的刺激下激活,通过靶基因转录调控肿瘤细胞的生长、增殖,抑制肿瘤细胞凋亡,最终诱发恶性肿瘤的发生发展[8]。STAT3通路已被证实与肺癌[9]、乳腺癌[10]等多种恶性肿瘤恶性程度及预后密切相关,Saini等[11]研究表明STAT3表达的增加和活化的STAT3(PIAS3)蛋白抑制剂功能的减弱或丧失,在卵巢高级别浆液性癌的恶性进程中发挥着重要作用。Morgan等[12]研究表明STAT3在HPV的生命周期中发挥关键作用,与正常的角质形成细胞比较,含有高危HPV18基因组的原代人角质形成细胞表现出STAT3的高度磷酸化,且在HPV阳性的宫颈疾病活检组织中检查到STAT3的表达和磷酸化增加,由此更加突显了STAT3的激活在宫颈癌发生中的作用。STAT3亦可以通过激活S-期激酶相关蛋白2(Skp2)而使p27基因的表达下调,进而调控细胞周期,STAT3的高表达可通过激活Skp2/p27/p21途径来促进肿瘤细胞的侵袭[13]。国外学者发现STAT3可通过与HOTAIR启动子区结合从而调控HOTAIR转录,协同调控子宫颈癌细胞的增殖与迁移[14]。本研究中发现宫颈癌中STAT3的表达与宫颈癌的FIGO分期、盆腔淋巴结转移情况及肌层浸润深度均有关,可见STAT3在宫颈癌的恶性进展中发挥着不容忽视的作用。此外,STAT3与宫颈癌的预后有一定关系,Huang等[15]学者研究发现宫颈癌中STAT3的过表达还与顺铂(DDP)耐药性相关,降低STAT3的表达可显著促进宫颈癌细胞的凋亡,降低DDP耐药性。由此,临床可通过治疗前检测宫颈癌组织中STAT3的表达来评估新辅助化疗后的预后情况。
HMGB1是几乎存在于所有的真核细胞内的一种DNA结合蛋白,由215个氨基酸组成,活化细胞中产生的HMGB1是经乙酰化后从细胞核转移至细胞质,再经过溶酶体胞吐到细胞外[16],可在细胞内外发挥不同的作用[17]。其在细胞核内能够稳定核小体、重组修复损伤的DNA和调节基因转录,在细胞外能够促进各种细胞及组织的修复。此外,HMGB1还参与肿瘤血管的生成及肿瘤组织的发展[18]。本研究提示HMGB1高表达于宫颈癌组织,且与患者的年龄、盆腔淋巴结转移情况及肌层浸润深度有关。Pang等[19]研究发现HMGB1在正常宫颈组织、宫颈上皮内瘤变组织、宫颈癌组织中的表达呈逐渐增高的趋势,且其在宫颈癌组织中的表达与淋巴结转移、肌层浸润深度有关,与本研究结果相符。HMGB1与宫颈癌细胞的入侵和转移可能通过激活NF-κB信号通路来实现,且Pang等[19]通过进一步实验发现HMGB1介导的对Hela细胞的刺激引起了其形态学的变化,可显著地增加细胞间空隙,降低细胞间黏附性,促进细胞的自由迁徙力。本研究发现宫颈癌组织中STAT3与HMGB1的表达呈正相关。说明两指标存在一定的相互关系。有研究[20]表明,在HMGB1介导的众多肿瘤相关信号调控机制中,酪氨酸激酶-信号转导及转录激活因子(JAK-STAT)通路是其重要的信号通路之一,在HMGB1及其他外界信号的刺激下,JAK激酶活化后磷酸化激活STAT3,通过促进下游基因表达促进细胞周期的进程。此外,HMGB1亦可以通过JAK/STAT3途径来调控干细胞标志物Nanog蛋白从而调控肿瘤干细胞的自我更新[21]。
综上所述,STAT3、HMGB1在宫颈癌中的表达升高,提示二者均参与宫颈癌的发生发展,但二者之间的作用关系有待进一步深入研究。本研究结果提示STAT3及HMGB1有望联合应用作为临床上诊断宫颈癌及判定预后的指标,并作为潜在靶点成为治疗宫颈癌的新手段。
[参考文献]
[1] Ferlay J,Shin HR,Bray F,et al. Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008 [J]. Int J Cancer,2010,127(12):2893-2917.
[2] Wagner KU,Schmidt JW. The two faces of Janus kinases and their respective STATs in mammary gland development and cancer [J]. J Carcinog,2011,10:32.
[3] Pilzweger C,Holdeieder S. Circulating HMGB1 and RAGE as Clinical Biomarkers in Malignant and Autoimmune Diseases [J]. Diagnostics (Basel),2015,5(2):219-253.
[4] 林仲秋,王麗娟,刘龙阳.国际妇产科联盟2012宫颈癌诊治指南解读[J].中国实用妇科与产科杂志,2013,29(5):323-325.
[5] Mattern J,Koom?覿gi R,Volm M. Association of vascular endothelial growth factor expression with intratumoral microvessel density and tumour cell proliferation in human epidermoid lung carcinoma [J]. Br J Cancer,1996,73(7):931-934.
[6] Kim S,Cho SW,Min HS,et al. The Expression of Tumor-Associated Macrophages in Papillary Thyroid Carcinoma [J]. Endocrinol Metab (Seoul),2013,28(3):192-198.
[7] 孙红,刘伟伟,姜红伟.八珍汤对宫颈癌术后化疗患者血清肿瘤坏死因子及免疫球蛋白水平的影响[J].国际中医中药杂志,2011,33(8):722-723.
[8] Zhang P,Li H,Yang B,et al. Biological significance and therapeutic implication of resveratrol-inhibited Wnt, Notch and STAT3 signaling in cervical cancer cells[J].Genes Cancer,2014,5(5/6):154-164.
[9] Li S,Mei Z,Hu H B. The lncRNA MALAT1 contributes to non-small cell lung cancerdevelopment via modulating miR-124/STAT3 axis[J]. J Cell Physiol,2018,233(9):6679-6688.
[10] Banerjee K,Resat H. Constitutive activation of STAT3 in breast cancer cells:A review[J].Int J Cancer,2016,138(11):2570-2578.
[11] Saini U,Suarez AA,Naidu S,et al. STAT3/PIAS3 levels serve as"early signature"genes in the development of high-grade serous carcinoma from the fallopian tube [J]. Cancer Res,2018,78(7):1739-1750.
[12] Morgan EL,Wasson CW,Hanson L,et al. STAT3 activation by E6 is essential for the differentiation-dependent HPV18 life cycle [J]. PLoS Pathog,2018,14(4):e1006975.
[13] 张自辉,叶红,刘秀娟.信号转导和转录激活因子3与宫颈癌的关系研究进展[J].山东医药,2015,55(4):105-107.
[14] Fan Z,Cui H,Xu X,et al. MiR-125a suppresses tumor growth, invasion and metastasis in cervical cancer by targeting STAT3 [J]. Oncotarget,2015,6(28):25266-25280.
[15] Huang LL,Rao W. SiRNA interfering STAT3 enhances DDP sensitivity in cervical cancer cells [J]. Eur Rev Med pharmacol Sci,2018,22(13):4098-4106.
[16] Rabadi MM,Xavier S,Vasko R,et al. High-mobility group box 1 is a novel deacetylation target of Sirtuin1 [J]. Kidney Int,2015,87(1):95-108.
[17] Zhang QY,Wu LQ,Zhang T,et al. Autophagy-mediated HMGB1 release promotes gastric cancer cell survival via RAGE activation of extracellular signal-regulated kinases 1/2 [J]. Oncol Rep,2015,33(4):1630-1638.
[18] 陳刚,庄昉成.高迁移率族蛋白B1及其在宫颈癌中的作用[J].国际肿瘤学杂志,2017,44(3):235-238.
[19] Pang X,Zhang Y,Zhang S. High-mobility group box 1 is overexpressed in cervical carcinoma and promotes cell invasion and migration in vitro [J]. Oncol Rep,2017,37(2):831-840.
[20] Wang H,Cai HB,Chen LL,et al. STAT3 Correlates with Stem Cell-related TranscriptionFactors in Cervical Cancer [J]. J Huazhong Univ Sci Technolog Med Sci,2015, 35(6):891-897.
[21] Do DV,Ueda J,Messerschmidt DM,et al. A genetic and developmental pathway from STAT3 to the OCT4-NANOG circuit is essential for maintenance of ICM lineages in vivo [J]. Genes Dev,2013,27(12):1378-1390.
(收稿日期:2019-3-11 本文编辑:顾家毓)
扩展阅读文章
推荐阅读文章
77范文网 https://www.hanjia777.com
Copyright © 2015-2025 . 77范文网 版权所有
Powered by 77范文网 © All Rights Reserved. 备案号:粤ICP备15071480号-27